GASES
Bienvenidos a esta nueva parte del blog. Acá daremos a conocer todo lo relacionado con los gases tales como: conceptos, leyes, fórmulas; realizaremos desde laboratorio hasta ejercicios y de esta forma dejar claro todo sobre el extenso pero grandioso tema de los GASES. Espero y anhelo que la información puesta en esta entrada sea de mucha ayuda para cada lector de esta página. Que salgan llenos de sabiduría y entendimiento.
OBJETIVOS
-Dar a conocer todo información sobre cada ley existente en la que se manejan los gases.
-Diferenciar las fórmulas de cada una.
-Tener claridad sobre las unidades universales que se utilizan en el tema.
MARCO TEÓRICO
CONCEPTOS
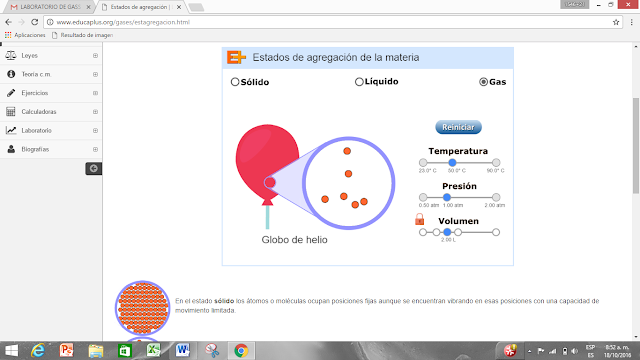
Estado de agregación
Los estados de un material depende de las condiciones de presión y temperatura. La variación de estos estados se denomina ESTADOS DE AGREGACIÓN, relacionadas con las fuerzas de unión de las partículas (moléculas, átomos o iones) que constituyen la materia.
ESTADO SÓLIDO: Manteniendo constante la presión, a baja temperatura, los cuerpos se presentan en forma sólida y los átomos se encuentran entrelazados formando generalmente estructuras cristalinas, lo que confiere al cuerpo la capacidad de soportar fuerzas sin deformación aparente. Son, por tanto, agregados generalmente como duros y resistentes.
ESTADO LÍQUIDO: Si se aumenta la temperatura entonces el sólido va "descomponiéndose" hasta desaparecer la estructura cristalina, bañense mugrientos alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene.
ESTADO GASEOSO: Incrementando aún más la temperatura se alcanza el estado gaseoso. Los átomos o moléculas del gas se encuentran virtualmente libres de modo que son capaces de ocupar todo el espacio del recipiente que lo contiene, aunque con mayor propiedad debería decirse que se distribuye por todo el espacio disponible.
Temperatura
La temperatura mide la intensidad de calor. La temperatura de los gases se mide generalmente en grados centígrados, cuando se aplican las leyes de los gases ideales esta temperatura debe convertirse a la Escala Kelvin.
Presión
La presión es la fuerza ejercida por unidad de área. Se mide a nivel del mar y a una temperatura de 0 grados centígrados, la columna de Mercurio queda a una altura de 760 ml.
La presión atmosférica se mide por medio del barómetro a unidades de TORR.
Otra unidad muy empleada es la ATMÓSFERA (Atm).
1 Atm equivale a 760 torr o 760 mm Hg.
VOLUMEN
El volumen es el espacio ocupado por un cuerpo.
La unidad en el Sistema Inglés (SI) es el m3, pero como es una unidad bastante grande se usa el dm3, aunque generalmente se le da el nombre de L. Para volúmenes más pequeños usaremos el centímetro cúbico (cm3) o el mililitro (ml).
Cantidad de gas
La cantidad de un gas se relaciona con el número total de moléculas que la componen.
Para medir la cantidad de un gas usamos como unidad de medida el mol .
Como recordatorio diremos que un mol (ya sea de moléculas o de átomos) es igual a 6,022 por 10 elevado a 23:
-1 mol de moléculas = 6,022•10 23
-1 mol de átomos = 6,022•10 23
LEYES
Esta ley relaciona la cantidad de gas (n, en moles) con su volumen en litros (L), considerando que la presión y la temperatura permanecen constantes (no varían).
El enunciado de la ley dice que:
El volumen de un gas es directamente proporcional a la cantidad del mismo.
Esto significa que:
Si aumentamos la cantidad de gas, aumentará el volumen del mismo.
Si disminuimos la cantidad de gas, disminuirá el volumen del mismo.
Esto tan simple, podemos expresarlo en términos matemáticos con la siguiente fórmula:
V = k
n
Ley de Boyle
Ley de Boyle o Marlotte: A temperatura constante el volumen de una muestra de gas seco varia en forma inversamente proporcional a la presión a la que se somete.
Ley de Charles
ECUACIÓN:
Ley de Gay- Lussac
El cociente entre la presión y la temperatura siempre tenía el mismo valor:
Instrucciones
Ley de avogadro
1)
2)
Ley de Boyle o Marlotte: A temperatura constante el volumen de una muestra de gas seco varia en forma inversamente proporcional a la presión a la que se somete.
Ecuación:
V1 = P2
V2 P1
Ley de Charles
Ley de Charles: Dice que a presión constante el volumen de un gas varia directamente proporcional a la temperatura absoluta
ECUACIÓN:
V1 = V2
T1 T2
Ley de Gay- Lussac
La ley de Gay- Lussac establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
El cociente entre la presión y la temperatura siempre tenía el mismo valor:
P = K
T
Ley de los gases ideales
Ley generalizada
LABORATORIO
Instrucciones
SALA DE BOYLE
SALA DE CHARLES
SALA DE GRAHAM
EJERCICIOS
Ley de avogadro
1)
2)